Las 5 cosas más importantes que debe saber sobre el nuevo fármaco contra el VIH: el fostemsavir
Por:
- Dor Partosh, BPharm, candidato a PharmD
Facultad de Farmacia, Universidad Nova Southeastern - Luis Urbina, candidato a PharmD
Facultad de Farmacia, Universidad Nova Southeastern - Elizabeth Sherman, doctora en farmacia, AAHIVP
Facultad de Farmacia, Nova Southeastern University
Sur de Florida, Centro de Educación y Formación sobre el SIDA del sudeste
El 2 de julio de 2020, la Administración de Alimentos y Medicamentos de los Estados Unidos aprobó el fostemsavir (Rukobia®), un inhibidor de la adhesión al VIH-1, el primero de su clase. El fostemsavir es un profármaco hidrolizado por la fosfatasa alcalina en el intestino delgado a la fracción activa, el temsavir. Se une directamente a la gp120 del VIH-1, lo que impide la adhesión inicial del virus y la entrada en las células T CD4+ del huésped. El mecanismo de acción del fostemsavir es único; otros inhibidores de la entrada del VIH-1 actúan en diferentes fases de entrada en las células T CD4+ del huésped. El fostemsavir está indicado, en combinación con otros antirretrovirales, para pacientes con gran experiencia en el tratamiento debido a la resistencia, la intolerancia o las consideraciones de seguridad. No se ha estudiado en pacientes que no han recibido tratamiento previo, ni es probable que se estudie en esta población de pacientes. La dosis recomendada del fostemsavir es un comprimido de 600 mg de liberación prolongada que se toma por vía oral dos veces al día, con o sin comida. No debe masticarse, triturarse ni partirse debido a la naturaleza de liberación prolongada del comprimido.1-3 A continuación se resumen las 5 cosas principales que todos los médicos deben saber antes de recetar el fostemsavir.
El fostemsavir se reserva para pacientes con una gran experiencia de tratamiento con opciones limitadas de tratamiento antirretroviral, como se demostró en el ensayo BRIGHTE[4].
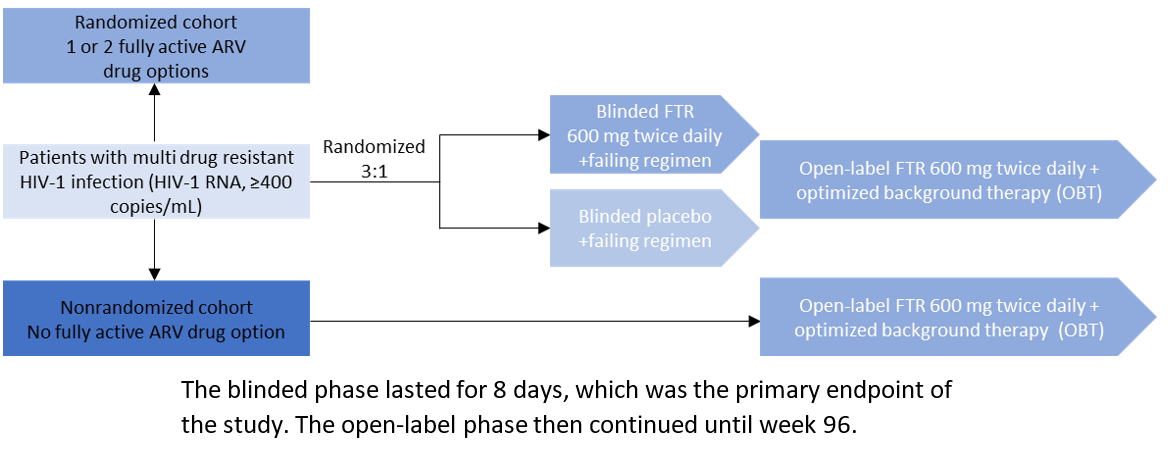
El estudio BRIGHTE fue el principal ensayo clínico que llevó a la aprobación del fostemsavir. En el ensayo participaron pacientes de 108 centros de 23 países de seis continentes. Los pacientes elegibles eran adultos (≥18 años de edad) que se habían sometido a múltiples tratamientos para la infección por el VIH-1. Todos los pacientes que tuvieron una falla en su régimen antirretroviral actual (definido como el ARN del VIH-1 ≥400 copias por mililitro) y no disponían de un tratamiento combinado antirretroviral viable debido al agotamiento de al menos cuatro de las seis clases de antirretrovirales (inhibidores nucleósidos de la transcriptasa inversa, inhibidores no nucleósidos de la transcriptasa inversa, inhibidores de la integrasa, inhibidores de la proteasa, antagonistas del CCR5 e inhibidores de entrada) debido a la resistencia, la intolerabilidad, la contraindicación o las preocupaciones de seguridad.4 La metodología del estudio se resume en la Figura 1 a continuación. En el estudio, se trataron 371 pacientes: 272 en la cohorte aleatorizada y 99 en la cohorte no aleatorizada. En la cohorte aleatorizada, se evaluó la respuesta virológica (<40 copias/ml de ARN del VIH-1) en las semanas 24 (53 %) y 96 (60 %). En la cohorte no aleatorizada, la respuesta virológica fue del 37 % tanto en la semana 24 como en la 96.1
Figura 1: Diseño del ensayo BRIGHTE
El fostemsavir tiene un perfil de efectos secundarios único y puede causar ciertas anomalías de laboratorio.
El efecto secundario más frecuente cuando se toma el fostemsavir son las náuseas (10 %). Se debe asesorar a los pacientes sobre este potencial efecto secundario. En los ensayos clínicos con el fostemsavir se observaron ciertas anomalías de laboratorio, incluyendo un aumento de la creatinina sérica de > 1.8 veces la ULN o 1.5 veces el valor basal (19 % de los pacientes de la cohorte aleatorizada) y un aumento de la bilirrubina directa >ULN (7 % de los pacientes de la cohorte aleatorizada).1 Estas anomalías fueron más prevalentes en pacientes con comorbilidades relacionadas, como la enfermedad renal crónica y la diabetes, en el caso de los aumentos de la creatinina sérica, y en la sepsis o la hepatitis viral, en el caso de los aumentos directos de la bilirrubina. No se ha establecido una relación entre estos casos y en su mayoría fueron de naturaleza transitoria. Estas anomalías con frecuencia se resolvieron con la continuación del tratamiento y no tuvieron importancia clínica. Además, se han observado aumentos de las transaminasas hepáticas en los estudios clínicos del fostemsavir y se observaron en una mayor proporción de pacientes con coinfección por hepatitis B o hepatitis C. Algunos de estos aumentos de las transaminasas fueron coherentes con la reactivación de la hepatitis B. Los pacientes coinfectados que empiezan a tomar el fostemsavir deben mantenerse adecuadamente con un tratamiento eficaz para la hepatitis B.
El fostemsavir es metabolizado por el sistema enzimático del citocromo P450 y tiene muchas interacciones farmacológicas clínicamente significativas con otros medicamentos.
Los inductores potentes del P450 pueden reducir las concentraciones del fármaco fostemsavir y su uso está contraindicado con el fostemsavir. Estos incluyen los inhibidores de los receptores de andrógenos (enzalutamida), los anticonvulsivos (carbamazepina, fenitoína), los antineoplásicos (mitotano), los productos a base de hierbas (hierba de San Juan) y los antimicobacterianos (rifampicina). La rifabutina se puede coadministrar de forma segura con el fostemsavir y puede ser una alternativa adecuada si las interacciones farmacológicas impiden el uso de la rifampicina.1
Es importante destacar que, cuando el fostemsavir se administra conjuntamente con el etinilestradiol, contenido en algunos anticonceptivos orales, la concentración del etinilestradiol aumenta aproximadamente un 40 % tanto en el AUC como en la Cmáx. Por lo tanto, la dosis máxima diaria de EE no debe superar los 30 µg y se recomienda precaución en pacientes con otros factores de riesgo de eventos tromboembólicos. 5
Por último, el fostemsavir no tiene interacciones farmacológicas clínicamente significativas con otros agentes antirretrovirales y puede coadministrarse de forma segura con cualquier régimen antirretroviral disponible actualmente. 5
El fostemsavir no requiere un ajuste de la dosis hepática o renal, incluyendo la diálisis.
El fostemsavir no requiere ajustes de dosis renales o hepáticas. El fostemsavir se ha estudiado en pacientes con función renal normal (eGFR> 90 ml/min/1.732), disminución leve de la función renal (eGFR) 89-60 ml/min/1.732), disminución moderada de la función renal (eGFR <60-30 ml/min/1.732), disminución grave de la función renal (eGFR <30 ml/min/1.732 no está en hemodiálisis) y disfunción renal terminal (eGFR <30 ml/min/1.732 en hemodiálisis). En cada una de las etapas, el impacto sobre la Cmáx del fostemsavir no fue clínicamente significativo6. No es necesario ajustar la dosis en los pacientes con insuficiencia renal o en diálisis. Del mismo modo, el fostemsavir se ha estudiado en pacientes con insuficiencia hepática (puntuación A, B y C de Child Pugh) y no es necesario ajustar la dosis en pacientes con insuficiencia hepática leve, moderada o grave. 1
El fostemsavir no presenta resistencia cruzada in vivo con otros antirretrovirales, incluyendo otros inhibidores de entrada.
La actividad antiviral del temsavir no es antagónica en el cultivo celular cuando se combina con otros inhibidores de entrada, incluyendo el ibalizumab, el maraviroc o la enfuvirtida. Los médicos pueden recetar de forma segura más de un inhibidor de entrada a los pacientes. Sin embargo, los inhibidores de entrada fostemsavir, ibalizumab y maraviroc pueden desarrollar resistencia en la gp120. No obstante, no hay prueba in vivo de resistencia cruzada. Los virus resistentes a la enfuvirtida, un inhibidor de la fusión de la gp41, conservan su susceptibilidad al temsavir.1
Referencias
- Rukobia [package insert]. Research Triangle Park, NC: GlaxoSmithKline; 2020.
- Moore K, Magee M, Ackerman P, et al. Pharmacokinetics of temsavir, the active moiety of the prodrug fostemsavir, in subjects with hepatic impairment. IDWeekTM 2017, San Diego, CA, USA. October 4-8, 2017: Abstract 1390.
- Lagishetty C, Moore K, Ackerman P, et al. Effects of temsavir, active moiety of antiretroviral agent fostemsavir, on QT interval: Results from a phase I study and an exposure–response analysis. Clin Transl Sci. 2020;13(4):769-776. doi:10.1111/cts.12763
- Kozal M, Aberg J, Pialoux G, et al. Fostemsavir in adults with multidrug-resistant HIV-1 infection. N Engl J Med. 2020;382(13):1232-1243.
- Moore K, Magee M, Ackerman P y col. Fostemsavir drug-drug interaction profile, an attachment inhibitor and oral prodrug of temsavir, for heavily treatment-experienced HIV-1 infected patients. IDWeekTM 2019, Washington, DC, USA. October 2-6, 2019: Abstract 2500.
- Moore K, Magee M, Ackerman P y col. Impact of mild, moderate and severe renal impairment and hemodialysis on temsavir pharmacokinetics following oral administration of fostemsavir, an attachment inhibitor for heavily treatment experienced HIV-1 infected patients. HIV Drug Therapy Glasgow 2019, Glasgow, UK. October 28-31, 2018: Abstract P261.