
¡HACIENDO, HACIENDO, HACIENDO! Conozca a los 2 nuevos luchadores que han subido al ring contra la enfermedad neumocócica: PCV15 y PCV20.
Por: Stephanie Suarez, candidata a PharmD1, Elguis Pérez, candidata a PharmD1, Elizabeth Sherman, PharmD1,2
- Facultad de Farmacia, Universidad Nova Southeastern
- Centro de educación y capacitación sobre el SIDA del sur de Florida, sureste
Antecedentes
El Comité Asesor sobre Prácticas de Vacunación (ACIP) recomendó dos nuevos regímenes de vacunación antineumocócica el 20 de octubre de 2021, una dosis de la vacuna antineumocócica conjugada PCV15 (Vaxneuvance) seguida de una dosis de la vacuna antineumocócica polisacárida PPSV23 (≥1 año después) o una dosis de PCV20 (Prevnar20), en adultos ≥65 años o entre 19-64 años con un aumento de los factores de riesgo de enfermedad neumocócica.1 Antes de estas actualizaciones, las vacunas disponibles se limitaban a la PCV13 y la PPSV23. Las recomendaciones de los Centros para el Control y la Prevención de Enfermedades (CDC) de 2019 consistieron en incluir solo la PCV13 y la PPSV23 para los adultos más jóvenes con un mayor riesgo de padecer la enfermedad neumocócica y para los adultos ≥65 años. Consulte la Tabla 1 para ver una comparación entre las directrices de los CDC sobre la vacuna antineumocócica de 2019 y 2022 según la población que recibe tratamiento. Los proveedores de atención del VIH deben estar familiarizados con estos regímenes de vacunación actualizados, ya que ofrecen un enfoque más simplificado para la prevención de la neumonía en una población de pacientes con mayor riesgo.
El 7 de septiembre de 2022, los Institutos Nacionales de Salud, los CDC y el Panel de la Asociación de Medicina del VIH de la Sociedad Americana de Enfermedades Infecciosas publicaron directrices actualizadas sobre infecciones oportunistas para personas con el VIH. Estas directrices concuerdan con las recomendaciones de vacunación antineumocócica de los CDC para 2022. Según las actualizaciones de las directrices sobre infecciones oportunistas, los pacientes con células CD4 ≥200/mm3 deben recibir una dosis de la PPSV23 al menos 8 semanas después de la PCV15. Por otro lado, a los pacientes con CD4 <200 células/mm3 (y preferiblemente <100,000 copias de ARN del VIH por ml) se les puede ofrecer la PPSV23 después de recibir la PCV15; sin embargo, la PPSV23 debe aplazarse hasta que el recuento de CD4 aumente a >200 durante el tratamiento antirretroviral.2
PCV15 en pocas palabras
La PCV15 fue aprobada por la FDA en julio de 2021. Además de los serotipos incluidos en la PCV13, la PCV15 también contiene los serotipos 22F y 33F. Adultos sanos ≥50 años, adultos con infecciones por el VIH de ≥18 años, adultos nativos americanos de entre 18 y 49 años o adultos con ≥1 factor de riesgo de enfermedad neumocócica (es decir, enfermedad cardíaca, hepática o pulmonar crónica, diabetes mellitus, infección por el VIH, leucemia, linfoma, trasplantes de órganos sólidos, alcohólicos, fumadores de cigarrillos, insuficiencia renal, anemia drepanocítica, Hodgkins, implantes cocleares, fuga de líquido cefalorraquídeo, síndrome nefrótico, inmunosupresión iatrogénica, neoplasias malignas generalizadas e inmunodeficiencia o asplenia congénita o adquirida) fueron todos evaluados en ensayos clínicos para determinar la inmunogenicidad y la seguridad del PCV15. Un estudio incluyó a 302 pacientes con infección por el VIH. Uno de los ensayos de fase 3 con adultos ≥50 años mostró que la PCV15 no era inferior a la PCV13.3 Los eventos adversos más frecuentes que se produjeron fueron las reacciones en el lugar de la inyección, la fatiga y la mialgia. Desde el punto de vista de la seguridad, los eventos adversos graves (SAE) del PCV15 se produjeron en el 2.5 % de los pacientes de los ensayos en los que participaron pacientes de 18 años o más.
PCV20 en pocas palabras
La PCV20 fue aprobada por la FDA en junio de 2021. La PCV20 tiene múltiples serotipos de polisacáridos neumocócicos (8, 10A, 11A, 12F, 15B, 22F, 33F), incluyendo los de la PCV13. Los eventos adversos más frecuentes que se produjeron en estos pacientes fueron dolor muscular, reacciones en el lugar de la inyección, fatiga, dolor de cabeza y dolor articular. Los ensayos de seguridad de la PCV20 mostraron que los SAE se producen en el 1.5 % de los receptores. En los ensayos de la PCV20 comparados con la PCV13 y la PPSV23 en adultos de 60 a 64 años y adultos ≥18 años, la PCV20 demostró no ser inferior.4 En estos estudios, se incluyeron adultos con condiciones médicas estables, pero ninguno incluyó a adultos con condiciones inmunocomprometidas.
Cronograma de administración
Si un paciente tiene un historial de vacunación desconocido o que nunca ha recibido una vacuna antineumocócica, se le puede administrar una dosis de la PCV20 y listo, o se le puede administrar una dosis de la PCV15 seguida de una dosis de la PPSV23 al menos un año después. Sin embargo, se puede considerar la posibilidad de administrar la PCV15 y la PPSV23 con un intervalo de 8 semanas si el paciente presenta una condición inmunocomprometida (incluyendo el VIH), implantes cocleares o pérdida de líquido cefalorraquídeo; consulte la Figura 1 sobre el tiempo de administración. Si el paciente ya ha recibido una dosis de la PPSV23 y no ha recibido ninguna otra vacuna conjugada, se le puede administrar la PCV15 o la PCV20 al menos 1 año después de la PPSV23; consulte la Figura 2 sobre el tiempo de administración. No es necesario volver a vacunar a los pacientes una vez que tengan ≥65 años.5 Según las directrices del MMWR y el VIH: los pacientes que están infectados por el VIH y que anteriormente solo han recibido la PCV13 deben recibir la PPSV23 al menos 8 semanas después o las personas con el VIH que han recibido la PCV13 y la PPSV23 deben recibir un refuerzo de la PPSV23 al menos 5 años después de la primera dosis (ver Tabla 1).5
Comparación de costos
Los resultados y costos de salud se mostraron en los modelos económicos para la PCV15 y la PCV20 en comparación con las recomendaciones anteriores.1 La PCV20 solo en adultos de ≥65 años y de 19 a 64 años con un factor de riesgo subyacente mostró $39,000 y $11,000 a $292,000 por año de vida ajustado por calidad (QALY) ganado, respectivamente. Mientras que la PCV15 en serie con la PPSV23 para adultos de 65 años o más y para personas de 19 a 64 años con condiciones subyacentes mostró un aumento de $282,000 y $250,000 a $656,000 por QALY, respectivamente.
Resumen
En conclusión, las directrices de 2022 recomiendan dos nuevos regímenes de vacunas antineumocócicas. Se trata de una dosis de la PCV20 sola o una dosis de la PCV15 seguida, al menos un año después, de una dosis de la PPSV23. Estas vacunas muestran eficacia en adultos mayores ≥65 años con o sin condiciones inmunocomprometidas y en adultos de 19 a 64 años con factores de riesgo subyacentes. Si a un paciente se le administró previamente la PCV13, debe completar la PPSV23 en serie.6 Ambos regímenes de vacunación mostraron un mínimo de reacciones adversas; sin embargo, si se producen reacciones adversas, deben notificarse al sistema de notificación de reacciones adversas a la vacuna (VAERS). Tanto la PCV15 como la PCV20 deben almacenarse refrigeradas entre 36 °F y 46 °F y no deben congelarse. La administración conjunta de la vacuna antineumocócica con la vacuna contra la gripe (Fluarix/Fluad) ha demostrado ser segura e inmunogénica.1
| Población | Directrices para 20196 | Directrices para 20221 |
|---|---|---|
| 19-64 años de edad con riesgo subyacente* |
INMUNOCOMPETENTE 1 dosis de la PPSV23£ IMMUNOCOMPROMETIDOS€ 1 dosis de la PCV13 seguida de 1 dosis de la PPSV23 ≥8 semanas después y una 2da dosis de la PPSV23 ≥5 años después |
1 dosis de PCV20 o 1 dosis de la PCV15 seguida de una dosis de la PPSV23 ≥1 año después** |
| ≥65 años de edad |
NO INMUNOCOMPROMETIDO INMUNOCOMPETENTE£ 1 dosis de la PPSV23; si se ha administrado la PCV13, administre la PPSV23 ≥1 año después de la PCV13 y ≥5 años después de cualquier PPSV23 <65 años IMMUNOCOMPROMETIDOS€ 1 dosis de la PCV13 si no se ha vacunado previamente con la PCV13; 1 dosis de la PPSV23 ≥8 semanas después de la PCV13 y ≥5 años después de cualquier PPSV23 a los <65 años |
1 dosis de la PCV20 o 1 dosis de la PCV15 seguida de una dosis de la PPSV23 ≥1 año después*** |
*Condiciones subyacentes: alcoholismo, cardiopatía crónica, enfermedad hepática crónica, enfermedad pulmonar crónica, tabaquismo, diabetes mellitus, implante coclear, pérdida de líquido cefalorraquídeo, asplenia congénita o adquirida, anemia drepanocítica, insuficiencia renal crónica, inmunodeficiencias congénitas o adquiridas, neoplasia maligna generalizada, infección por VIH, enfermedad de Hodgkin, inmunosupresión latrogénica, leucemia, linfoma, mieloma múltiple, síndrome nefrótico, trasplante de órganos sólidos
£Condiciones inmunocompetentes: alcoholismo, cardiopatía crónica, enfermedad hepática crónica, enfermedad pulmonar crónica, tabaquismo, diabetes mellitus
$Condiciones inmunocompetentes: implante coclear y fuga de líquido cefalorraquídeo
€Condiciones inmunocomprometidas: asplenia congénita o adquirida, anemia drepanocítica, insuficiencia renal crónica, inmunodeficiencias congénitas o adquiridas, neoplasia maligna generalizada, infección por VIH, enfermedad de Hodgkin, inmunosupresión latrogénica, leucemia, linfoma, mieloma múltiple, síndrome nefrótico, trasplante de órganos sólidos
**Las condiciones inmunocomprometidas (incluyendo el VIH), la pérdida de líquido cefalorraquídeo o los implantes cocleares podrían beneficiarse de intervalos más cortos (≥8 semanas)
***Las condiciones inmunocomprometidas, las fugas de líquido cefalorraquídeo o los implantes cocleares podrían beneficiarse de intervalos más cortos. No se requiere ninguna vacuna antineumocócica adicional de la lista
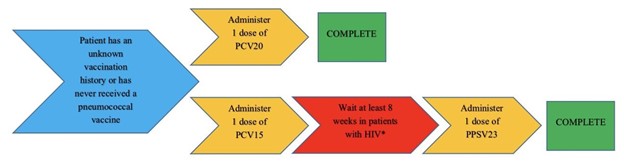
Figura 1: Calendario de vacunación para pacientes con el VIH con antecedentes de vacunación desconocidos o que nunca han recibido una vacuna antineumocócica5
*Los pacientes con CD4 ≥200 células/mm3 deben recibir una dosis de la PPSV23 y a los pacientes con CD4 <200 células/mm3 también se les puede ofrecer la PPSV23, especialmente si su ARN del VIH es de <100,000 copias/mL2
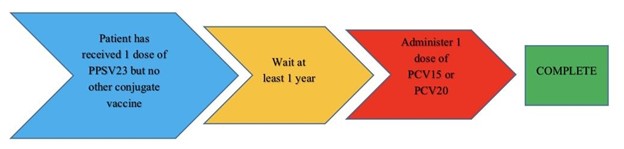
Figura 2: Calendario de vacunación para pacientes con el VIH que ya recibieron la PPSV235

Figura 3:Calendario de vacunación para las personas con el VIH que recibieron anteriormente la PCV132

Figura 4:Calendario de vacunación para las personas con el VIH que han recibido la PCV13 y la PPSV232
Referencias:
- Kobayashi M, et al. Use of 15-valent pneumococcal conjugate vaccine and 20-valent pneumococcal conjugate vaccine among U.S. adults: Updated recommendations of the Advisory Committee on Immunization Practices — United States, 2022. MMWR Morbidity and Mortality Weekly Report. 2022;71(4):109-117. doi:10.15585/mmwr.mm7104a1
- Immunizations for preventable diseases in adults and adolescents living with HIV: NIH. Immunizations for Preventable Diseases in Adults and Adolescents Living with HIV | NIH. https://clinicalinfo.hiv.gov/en/guidelines/hiv-clinical-guidelines-adult-and-adolescent-opportunistic-infections/immunizations?view=full. Published September 7, 2022. Último acceso el lunes, septiembre 12, 2022.
- Platt HL, et al. A phase 3 trial of safety, tolerability, and immunogenicity of V114, 15-valent pneumococcal conjugate vaccine, compared with 13-valent pneumococcal conjugate vaccine in adults 50 years of age and older (PNEU-AGE). Vaccine 2022;40:162–72. https://doi.org/10.1016/j.vaccine.2021.08.049external icon PMID:34507861
- Essink B, et al. 3. Phase 3 pivotal evaluation of 20-valent pneumococcal conjugate vaccine (PCV20) safety, tolerability, and immunologic noninferiority in participants 18 years and older. Open Forum Infect Dis 2020;7(Supplement_1):S2. https://doi.org/10.1093/ofid/ofaa417.002
- Pneumococcal vaccine timing for adults – centers for disease control. https://www.cdc.gov/vaccines/vpd/pneumo/downloads/pneumo-vaccine-timing.pdf. Published April 1, 2022. Último acceso el martes, 6 de septiembre de 2022.
- Matanock A, et al. Use of 13-valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine among adults aged ≥65 years: Updated recommendations of the Advisory Committee on Immunization Practices. Informe semanal de morbilidad y mortalidad del MMWR. 2019;68(46):1069-1075. doi:10.15585/mmwr.mm6846a5
